Общие сведения об озоне
В статье дано общее описание молекулы озона. Приведены химические реакции образования и схемы молекул озона. Перечислены основные сферы применения озона.
Что такое озон
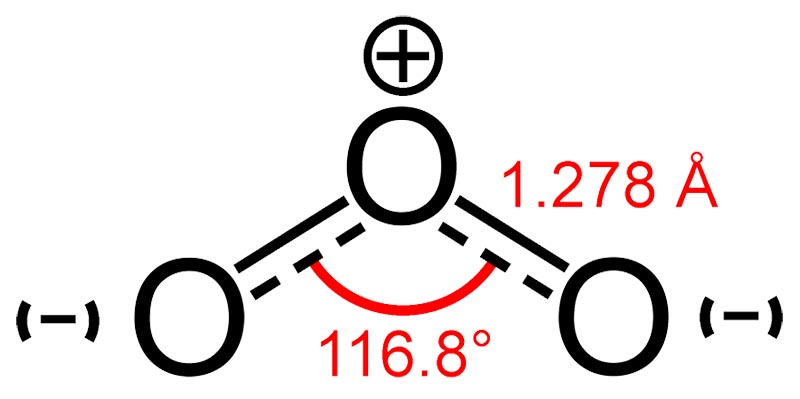
ОЗОН О3 (от греч. ozon-пахнущий) – аллотропная модификация кислорода, т. кип. 161,2 К; плотность газа при 273,2 К 2,141 г/л, при 298,2 К 1,962 г/л. Молекула может существовать во всех трех агрегатных состояниях. Озон – нестабильное соединение, при комнатной температуре медленно разлагается на молекулярный кислород, однако эта нестабильность не настолько велика, чтобы считать озон радикалом. При нормальных условиях озон это газ с резким запахом. При низких концентрациях ощущается как приятная свежесть, но с увеличением концентрации запах становится неприятным.
В реакциях с большинством веществ озон — сильный окислитель, что обусловлено низкой энергией отрыва атома О от молекулы О3 (107 кДж/моль) и высоким сродством молекулы озона к электрону (2,26 эВ). Растворимость озона в воде (0,21 объема в 1 объеме раствора при 298К) почти в 7 раз выше растворимости О2. Подробнее о физико-химических свойствах озона, можно прочитать в статье «Физико-химические свойства озона».
Молекулярное строение озона
Химическая реакция образования озона
Первичные реакции. Молекула кислорода под действием химических реакций или электрических разрядов может раздробиться:
O₂ ⇄ O + O;
Или сцепление между молекулами может ослабеть:
O₂ ⇄ O– + O–;
Вторичные реакции. Образовавшиеся в ходе первичных реакций атомы или комплексные соединения присоединятся к целым молекулам благодаря их молекулярному сродству:
O₂ + O ⇄ O₃;
O– + O– + O ⇄ O₃;
Схема строения молекулы озона
Молекула озона получается в результате особого сочетания атомов кислорода:
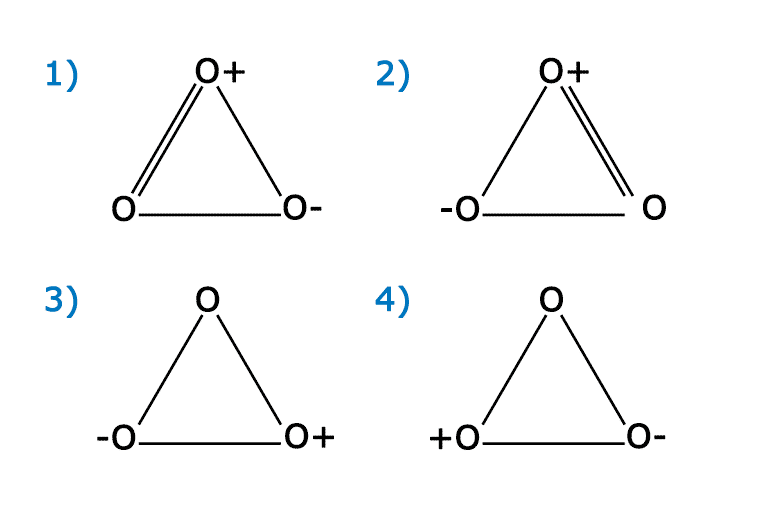
Молекула озона неустойчива и легко диссоциирует на кислород. Энергия необходимая для диссоциации — 100,5 кДж. Для диссоциации молекулы кислорода требуется 489,9 кДж. Реакция превращения озона в кислород является экзотермической.
Сферы применения озона
В химии:
- как сильный, универсальный окислитель;
- как основной источник образования атома O (1D).
- В химической технологии:
- в очистных комплексах химических производств;
- при дезинфекции и осветлении воды;
- при устранении запахов;
- при извлечении золота и серебра из руд.
В биологии:
- как вещество, воздействующее на микроорганизмы.
В физике:
- при создании полупроводников, жидких кристаллов, сверхпроводников, магнитных пленок.
В медецине:
- при заживлении ран, лечении заболеваний крови, органов зрения, дыхания;
- при хранении контактных линз и стерилизации медицинских инструментов.
В быту:
- для создания комфортной атмосферы в помещениях и их дезинфекции.
В сельском хозяйстве:
- при хранении продуктов, устранении пестицидов.
Список источников
- Физическая химия озона: монография / В.В. Лунин, М.П. Попович, С.Н. Ткаченко. – 2-е изд., испр. и доп. – Москва: МАКС Пресс, 2019. – 540 с.
- Озонирование воды / В.Ф. Кожинов, И.В. Кожинов – М. Стройиздат 1973 г. – 160 c.

